Коронарная недостаточность
Содержание
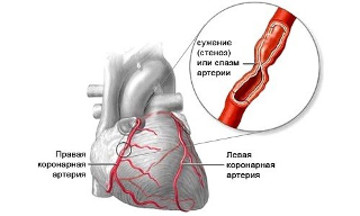 Коронарная недостаточность (КН) — типовая форма патологии сердца, патогенетическую основу которой составляет несоответствие между потребностью миокарда в кислороде и субстратах, необходимых для поддержания его обменно-энергетического и физико-химического гомеостаза, и возможностью их получения по системе коронарных сосудов.
Коронарная недостаточность (КН) — типовая форма патологии сердца, патогенетическую основу которой составляет несоответствие между потребностью миокарда в кислороде и субстратах, необходимых для поддержания его обменно-энергетического и физико-химического гомеостаза, и возможностью их получения по системе коронарных сосудов.
Коронарная недостаточность, как правило, детерминирует развитие локальной или диффузной гипоксии, т. е. дефицит макроэргических соединений в миокарде.
По механизмам развития различают две формы коронарной недостаточности: абсолютную и относительную.
Абсолютная коронарная недостаточность
Патогенетическую основу абсолютной коронарной недостаточности составляет снижение объемной скорости кровотока в сосудах кровоснабжения миокарда.
Объемная скорость кровотока — это количество крови, которое проходит через единицу площади поперечного сечения сосудистого русла за единицу времени. Объемная скорость прямо пропорциональна линейной скорости кровотока и обратно пропорциональна сопротивлению кровотока.
Линейная скорость зависит от градиента кровяного давления между артериальным и венозным отделами сосудистого русла, а сопротивление кровотоку — от диаметра/тонуса сосудов (преимущественно, макрососудов резистивного типа) и реологических свойств, т.е. текучести/вязкости крови, зависящих в основном в макрососудах от гематокрита, а в микрососудах — от деформационных свойств эритроцитов.
С учетом представленных факторов непосредственными причинами абсолютного (по сравнению с нормой) уменьшения коронарного кровотока являются:
1. Нарушения системного кровообращения, приводящие к снижению притока крови к сердцу:
• гиповолемические состояния (напр., при тотальной гипогидратации организма в условиях тяжелой острой кровопотери, выраженной плазморее, значительной полиурии, профузном поносе, неукротимой рвоте);
• артериальные вазодилатационные гипотензии (напр., при тяжелых формах токсикоинфекции, шоковых состояниях, центрогенных и рефлексогенных нарушениях вазомоторной регуляции, надпочечниковой недостаточности).
2. Нарушения насосной функции сердца:
• аортальная недостаточность, приводящая к снижению диастолического давления в аорте;
• тяжелые формы сердечных аритмий, характеризующиеся патогенетически значимым укорочением периода диастолического кровенаполнения коронарных сосудов и /или существенным нарушением его периодичности.
3. Увеличение сопротивления коронарному кровотоку.
• обтурация/облитерация венечных сосудов (сужение просвета сосудов при атеросклерозе, тромбозе, эмболии,коронарите);
• стенозирование устьев коронарных артерий при аортите;
• гемоконцентрация (например, нарушение микрореологии при полицитемии, гипогидратации организма);
• компрессия венечных сосудов (напр., при повышении внутрипо-лостного конечного диастолического давления, субэндотелиальном кровоизлиянии, фиброзировании миокарда, сдавлении сосудов спайками, опухолью, инородным телом);
• осмотическое набухание кардиомиоцитов, ведущее к уменьшению просвета сосудистого русла (напр., в условиях электролитностероидной миокардиопатии, характеризующейся повышением внутриклеточной концентрации Na+);
• коронарный ангиоспазм (развивается в условиях атеросклеротического поражения венечных сосудов при стрессе, физической нагрузке).
Патогенетической основой коронарного ангиоспазма, т.е. патологического (выраженного, продолжительного) спазма магистральных ветвей коронарных сосудов является повышенная чувствительность гладкомышечных клеток сосудистой стенки к вазоконстрикторным воздействиям: повышению сократимости таких клеток и/или снижению/задержке их расслабления.
Основными механизмами коронарного ангиоспазма, хе.повышения сократимости и/или снижения расслабляемости сосудов, являются:
• уменьшение активности Ка+/К+-АТФ-азы (причина – дефицит энергии макроэргов);
• задержка выхода Са++ из миофиламентов (причина – дефицит энергии макроэргов);
• снижение соотношения простациклин / тромбоксан А2 (причина — повреждение сосудистой стенки, индуцирующее накопление, т. е. адгезию и агрегацию тромбоцитов, которые являются источниками тромбокса-на А2 — мощного вазоконстриктора);
• повышение реактивности а-адренорецепторов магистральных отделов коронарных сосудов (активация этих рецепторов вызывает вазоконстрикцию). Попутно отметим, что стимуляция Р2-адренорецепторов мелких сосудов коронарного русла вызывает их вазодилатацию.
Атеросклероз коронарных сосудов
Атеросклероз — это хроническое очаговое поражение артерий, характеризующееся отложением в их внутренней оболочке (интиме) апопротеин В-содержащих липопротеидов и доставляемого ими холестерина, сопровождаемым структурно-клеточными изменениями и реактивным разрастанием соединительной ткани в средней оболочке сосудов (медии) с образованием фиброзных (атеросклеротических) бляшек, суживающих просвет сосудов, что приводит к расстройствам кровообращения.
Развитие атеросклероза может быть детерминировано, во-первых, атерогенной гиперлипидемией и, во-вторых, накоплением атерогенных липопротеидов в сосудистой стенке. Как правило, эти факторы едины в патогенезе атеросклероза.
Атерогенная дислипопротеинемия, а именно гиперлипопротеинемия IIb типа по Fredrikson, которая характеризуется увеличением в крови содержания атерогенных липопротеидов низкой плотности (ЛПНП) и очень низкой плотности (ЛПОНП), приводит к увеличению нерегулируемого эндоцитоза и межэндотелиального проникновения атерогенных липопротеидов в сосудистую стенку. Этот фактор может приводить к недостаточному их удалению в лимфатические сосуды и накоплению в интиме.
Очаговое отложение в интиме атерогенных липопротеидов (ЛП) может быть детерминировано:
1) увеличением их поступления в сосудистую стенку при атерогенной дислипопротеидемии;
2) нарушением для них рецепторно-опосредованной проницаемости эндотелия. Известно,что ЛП в норме могут проникать в сосудистую стенку по-разному:
• путем рецепторно-опосредованного, т.е. с помощью специфических ало В,Е- мембранно-связанных рецепторов, регулируемого захвата ЛП эндотелиоцитами с образованием т.н. «окаймленных эндоцитозньк везикул», которые затем сливаются с лизосомами. Освободившийся из лизосом свободный холестерин используют эндотелиоциты дня обеспечения их внутренней потребности. При этом избыток внутриклеточного холестерина ингибирует синтез апо В,Е-рецепторов и тем самым по типу отрицательной обратной связи ингибирует поступление атерогенных ЛП в эндотелий;
• путем пассивного транспорта через межэндотелиальные каналы с последующим без задержек проникновением ЛП в лимфатические капилляры.
Существует еще один путь проникновения ЛП в сосудистую стенку. Это практически нерегулируемый, опосредованный рецепторами низкого сродства [син.: «scavenger» (англ.: мусорщик) -рецепторов] захват ЛП с образованием неокаймленных (гладких) эндоцитозных везикул. В норме он незначителен; имеются основания считать, что он обеспечивает захват модифицированных (см. ниже) вне территории сосудистой стенки ЛП (напр., в печени может быть перекисное окисление ЛП).
При этом поступившие в эндотелиоциты ЛП транспортируются от плазматической мембраны эндотелия к его базальной мембране с последующим экзоцитозом в интиму и внутреннюю часть медии с выходом в лимфатические сосуды. Установлено, что именно этот трансэндотелиальный путь транспорта атерогенных Л П является основным поставщиком холестерина в интиму на начальных этапах развития атеросклеротического поражения сосудов.
Задержка атерогенных ЛП в основном обусловлена утолщением или уплотнением интимы. Основными причинами (иначе говоря, «факторами риска») такого повреждения сосудов являются:
• возрастная гиперплазия сосудистой стенки;
• стойкая артериальная гипертензия, поражение сосудов чаще всего происходит в местах воздействия повышенной гемодинамической нагрузки («гидравлической волны») на внутреннюю поверхность сосудов, напр. удары «сердца молотобойца» по дуге аорты уплотняют сосудистую стенку;
• инфекционно-токсические повреждения сосудов связывают прежде всего с герпесвирусом и хламидиозом (по данным ВОЗ, хламидиоз — это самое распространенное инфекционное заболевание, передаваемое половым путем). Ввиду того, что эти микроорганизмы были изолированы от некоторых атеросклеротических поражений, причинно-следственная связь пока не получила широкого признания.
Обнаружено, что пациенты с повышенным уровнем гомоцистеина подвержены атеросклерозу. В экспериментальных исследованиях установлено прямое токсическое действие гомоцистеина на эндотелиальные клетки;
• табакокурение. Никотин обладает плейотропизмом, в т. ч. способен:
а) увеличивать экспрессию фактора роста фибробластов 1 (FGF1) и его рецептора, что может приводить к активации пролиферативных процессов в сосудистой стенке и соответственно увеличению ее толщины;
б) уменьшать содержание в крови ЛПВП — антиатерогенных липопротеидов высокой плотности;
в) вызывать прямое повреждение эндотелиальных клеток;
г) повышать адгезивность тромбоцитов;
д) увеличивать свертываемость крови (активировать фибриноген и VII фактор гемокогуляции);
генетические дефекты сосудов, напр. генетически детерминированное появление патологического пролиферативного клона гладкомышечных клеток; наследственный дефицит специфических апо В,Е -мембранносвязанных рецепторов эндотелиальных клеток, «болезнь накопления
холестерина» в эндотелиоцитах, которая возникает при генетическом дефекте лизосомальной липазы;
• окислительный стресс (активные формы кислорода — это факторы повреждения сосудистой стенки; их количество зависит от баланса оксидантной и антиоксидантной систем).
До настоящего времени не создана единая общепринятая теория развития атеросклероза. Вместе с тем, выдвинуто достаточно много концепций (от лат. conception определенный способ понимания, трактовки каких-либо явлений), базирующихся на факторах риска атеросклероза. Как правило, различные представления об атеросклерозе объединяют в разных сочетаниях на основе их патогенетической взаимосвязи.
Сценарий одного из наиболее обоснованных вариантов патогенеза атеросклероза может быть представлен следующим образом.
Накопившиеся в интиме атерогенные липопротеиды подвергаются модификации (лат. «modiflcatio» — видоизменение чего-л. с приобретением новых свойств).
К основными механизмами модификации относят:
• гликилирование ЛП (при хронической гипергликемии);
• комплексирование ЛП с местными белками (коллагеном, эластином идр.);
• свободнорадикальное перекисное окисление ЛП;
• образование аутоиммунных комплексов «ЛП (модифицированные) + JgG»;
• ограниченный протеолиз ЛП.
Модифицированные ЛП слабо распознаются апо В,Е-рецепторами, но неограниченно их захватывают «scavenger»-рецепторы, которые находятся на макрофагах (моноцитах) и они способны фагоцитировать холестерин, превращаясь в т.н. пенистые клетки. Этот фагоцитоз, направленный на удаление атерогенных липопротеидов из интимы, сопровождается поступлением их макрофагов в окружающую среду целого спектра цитокинов: хемотаксических (активируют миграции моноцитов в область поражения сосуда), ростовых (стимулируют пролиферации фибробластов и гладкомышечных клеток) и адгезивных молекул (обеспечивают эмиграцию моноцитов).
В спектр этих цитокинов входят PDGF (тромбоцитарный фактор роста), IL-1 (интерлейкин -1) — лимфоцитактивирующий фактор, TNF-a (фактор некроза опухоли a), МСР-1 ( моноритарный хемоаттрактантный протеин 1) и др.
Следующий этап развития атеросклероза — образование бляшек, связанное с процессами пролиферации фибробластов и «синтетического» (пролиферативного) фенотипа гладкомышечных клеток (ГМК), трансформированного из привычного «контрактильного» пула ГМК сосудистой стенки. Затем включаются процессы разрушения пенистых клеток и дегенерации (лизис и фрагментация) волокнистых структур с развитием очагового некроза. Основными осложнениями фиброзной бляшки являются ее разрыв, сопровождаемый кровоизлиянием в стенку сосуда, и тромбоз сосудов.
При развитии тромбоза в зоне повреждения сосуда скапливается большое количество тромбоцитов, которые являются источником тромбоксана А 2. Этот циклический простагландин оказывает существенное влияние на просвет сосудов, т.к. считают его не только самым мощным фактором адгезии тромбоцитов — начального этапа тромбообразования, но и сильнейшим вазоконстриктором.
Атеросклероз коронарных сосудов обнаруживают на вскрытии практически у всех умерших от инфаркта миокарда. У подавляющего большинства больных стенокардией при ангиографии коронарных артерий выявляют выраженное сужение просвета как минимум одной из главных артерий сердца. В покое такое сужение сосуда не сопровождается признаками коронарной недостаточности. Однако при увеличении работы сердца пораженные атеросклерозом ригидные артерии не способны к адекватному расширению.
Таким образом, атеросклеротическое поражение сосудов и его осложнения являются основным фактором риска развития абсолютной коронарной недостаточности.
Кроме атеросклероза, абсолютная коронарная недостаточность может быть вызвана тромбозом венечных сосудов, сладжированием крови, ангиоспазмом, снижением не только расслабления миокарда в фазу диастолы, но и кровенаполнения сосудов при аортальной недостаточности и др.
Относительная коронарная недостаточность
Патогенетическую основу данной формы патологии составляет существенно повышенная потребность миокарда в энергии макроэргов, не обеспечиваемая даже увеличенным его кровоснабжением. Кроме того, она может быть обусловлена первичной недостаточностью интенсивности и/или эффективности биологического окисления в миокарде.
Причинами относительной коронарной недостаточности являются некоронарогенные факторы, которые обусловливают ее развитие даже при неизмененных венечных артериях сердца, при нормальном или повышенном притоке по ним кислорода и субстратов метаболизма к миокарду. К ним относят:
• гиперфункцию сердца — это наиболее частая причина увеличения потребления сердцем кислорода и субстратов метаболизма, превышающего их реальную доставку по коронарным артериям. Ведущим фактором увеличения метаболических запросов миокарда является активация симпатоадреналовой системы.
Повышение содержания катехоламинов в мышце сердца обусловливает чрезмерное увеличение потребления им кислорода и субстратов метаболизма, намного превосходящего возможности их доставки с кровью даже по максимально расширенным коронарным артериям;
• гипертрофию сердца (сосудистая необеспеченность миокарда в условиях развития гипертрофии миокарда), которая обусловлена отставанием ангиогенеза от увеличения его массы, напр., при артериальной гипертензии, при аортальном пороке сердца и т.д.;
• гемическую гипоксию (патогенетическая основа — снижение кислородной емкости крови) возникает при:
1) уменьшении количества гемоглобина в единице объема крови
— анемии (постгеморрагические, гемолитические, дизэритропоэти-ческие)
— гидремии (псевдоанемии)
2) качественных изменений гемоглобина Наследственные:
а) гемоглобинопатии;
б) эритроэнзимопатии Приобретенные:
а) отравление СО (НЬСО; карбоксигемоглобин);
б) окисление гемоглобина (окисленная форма НЬ — меттемоглобин);
в) повышение сродства НЬ к 02 при снижении 2,3-дифосфоглицерата в эритроцитах;
3) изменениях физико-химических условий, влияющих на оксигенацию и дезоксигенацию гемоглобина: pH, рС02,температуры крови;
• респираторную гипоксию (патогенетическая основа: уменьшение газообменной функции легких вследствие развития дыхательной недостаточности);
• экзогенную гипоксию [патогенетическая основа: уменьшение А р02 на уровне альвеоло-капиллярных мембран вследствие снижения содержания 02 во вдыхаемом воздухе (Р02 атм.)].
В отличие от абсолютной коронарной недостаточности лечебная тактика и стратегия лечения при относительной коронарной недостаточности направлена не на восстановление (повышение) объемной скорости коронарного кровотока, а на уменьшение потребности миокарда в энергии макроэргов, или при другом варианте ее развития — на устранение первичной гипоксии миокарда.
Широко известно понятие «ишемическая болезнь сердца (ИБС)»; синонимом ИБС является понятие «коронарная болезнь сердца». Данные понятия используют для обозначения патологии сердца, возникающей при поражениях коронарных сосудов органического или функционального характера. К органическим поражениям относят прежде всего и в основном атеросклеротические стенозы коронарных артерий, выявляемые примерно у 95% больных ИБС. В настоящее время варианты развития ишемии миокарда, вызываемой другими причинами (аномалии развития коронарных сосудов, коронариты, аортальные пороки), а также относительную коронарную недостаточность при гипертрофии миокарда к ИБС не относят. Их рассматривают в рамках других соответствующих заболеваний (“ишемия без ИБС”).
Одним из критериев, характеризующих коронарную недостаточность, является масштаб гибели (необратимого структурного повреждения) мио-кардиоцитов, которая неизбежно возникает при любой форме коронарной недостаточности как минимум в одном из ее вариантов — апоптоза или некроза. На сегодняшний день согласно Международный Классификации клеточной смерти различают более 10 морфологических типов гибели клеток: кроме некроза и апоптоза, выделяют аутофагию, «митотическую катастрофу”, партанотоз и др. Данный критерий является морфологической основой для различения обратимой (транзиторной) и необратимой форм коронарной недостаточности.
Обратимая коронарная недостаточность (в своем типичном варианте) характеризуется патогенетически незначимой гибелью миокардиоцитов, т. е. таким повреждением миокарда, которое не нарушает насосную функцию сердца. При необратимой коронарной недостаточности происходит патогенетически значимая утрата кардиомиоцитов, приводящая к нарушению насосной функции сердца.
Некроз кардиомиоцитов начинается после 20—30 минут ишемии и распространяется от эндокарда до эпикарда. Если ишемия сохраняется в течение 6—8 часов, то 70—80% клеток, кровоснабжаемых артерией, подвергнутой обтурированию, погибает. Включение коллатерального кровообращения из других интактных коронарных артерий может уменьшать ишемию в периферийных регионах миокарда.
функционально миокардиальные клетки быстро (в течение нескольких минут) теряют свою сократительную способность. Оказалось, что даже если также быстро кровоток восстанавливается, сократительная способность миокарда тем не менее остается сниженной, несмотря на отсутствие каких-либо патогенетически значимых гистологических изменений. Этот реперфузионный (иногда называемый “постперфузионный”) феномен связывают с тем, что восстановление кровообращения характеризуется временной перегрузкой Са2+ поврежденного участка миокарда и повышенной в нем генерацией активных форм кислорода, которые “оглушают” миокард. Спустя несколько дней сократительная способность такого участка постепенно нормализуется.
Обратимость/необратимость структурного повреждения миокарда является важным критерием различения основных клинических форм ишемической болезни сердц (ИБС) — стенокардии, инфаркта миокарда и кардиосклероза.
Обратимая коронарная недостаточность является морфологической основой стенокардии, а необратимая — морфологической основой инфаркта миокарда и кардиосклероза. Склерозирование миокарда происходит либо при многократно повторяющейся (как правило, на протяжении достаточно продолжительного периода) локальной обратимой коронарной недостаточности или в постинфарктном (как правило, после обширного некроза миокарда) периоде.
Клинический диагноз инфаркта миокарда базируется на трех постулатах:
1. Анамнез и status praesens (состояние здоровья пациента в момент медицинского обследования). Первое и самое важное в диагностике — это анамнез, полученный от пациента. Наиболее распространенным проявлением инфаркта миокарда является кардиалгический синдром («ангинозный статус», симптом «сжатого кулака»). Боль локализована преимущественно в области грудной клетки, по интенсивности она превышает болевые ощущения при стенокардии, которые продолжаются, как правило, более 30 минут, иногда несколько часов. Одновременно с болью возникают страх смерти, двигательное беспокойство, профузное потоотделение, могут быть диспепсические явления (тошнота, рвота), одышка и т. д.
2. Электрокардиография (изменения ЭКГ при различных ишемических синдромах, включая инфаркт миокарда, описаны ниже в разделе острый коронарный синдром).
3. Анализ крови, в т.ч. определение миокардиальных ферментов и белков.
Три фермента традиционно используют для диагностики инфаркта миокарда: аспартатаминотрансфераза (ACT), лактатдегидрогеназа (ЛДГ) и креатинфосфокиназа (КФК). Наиболее часто определяют КФК — фермент, который участвует в реакциях энергообразования, катализируя перенос фосфата сАТФ на креатин. У КФК имеется 3 изоформы: I (ВВ), II (МВ) и III (ММ). Обычно интересуются содержанием II (МВ), т.к. увеличение этой изоформы КФК происходит в течение первых суток после инфаркта миокарда и в 100% случаев подтверждает данный диагноз. Однако уже через 2—3 суток происходит нормализация активности данного фермента, поэтому в эти сроки после развития инфаркта такой анализ уже не проводят.
В настоящее время «золотым стандартом» биохимической диагностики инфаркта миокарда считают обнаружение в крови кардиоспецифических сократительных белков тропонинов: Тн1 (Troponin I) и ТнТ (Troponin Т). При анализе крови в условиях развития инфаркта миокарда обычно, кроме названных ферментов и тропонинов, которые проникли в кровь вследствие их «утечки» из кардиомиоцитов, в ней обнаруживают увеличенное содержание белков острой фазы, появление С-реактивного белка, ускорение СОЭ. Все эти неспецифические свидетели инфаркта миокарда в совокупности с закономерно развивающейся лихорадкой нередко объединяют понятием «резорбционно-некротический синдром».



