Архитектоника и моторика кардиомиоцитов
Содержание
Сократительные клетки миокарда
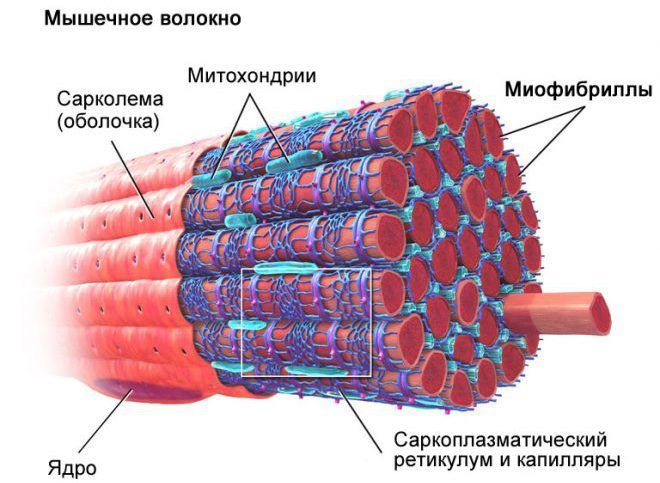 Сократительные клетки миокарда (син.: типичные кардиомиоциты) образованы продольно уложенными органеллами — миофибриллами, которые в свою очередь состоят из саркомеров — последовательно соединенных сократительных единиц.
Сократительные клетки миокарда (син.: типичные кардиомиоциты) образованы продольно уложенными органеллами — миофибриллами, которые в свою очередь состоят из саркомеров — последовательно соединенных сократительных единиц.
Роль сократительных единиц выполняют специализированные белковые молекулы, которые могут взаимодействовать друг с другом и вызывать укорочение саркомера, что детерминирует сокращение кардиомиоцита. Специализированные белковые молекулы представлены, во-первых, сократительными белками (миозином и актином), которые образуют соответственно толстые миозиновые и тонкие акгиновые филаменты, а во-вторых, регуляторными белками (тропонином и тропомиозином).
Толстые миозиновые филаменты закреплены на М-линии, а тонкие — на Z-линии. Каждые две соседние Z-линии являются границами саркомера. Перекрытия толстых и тонких нитей образуют т. н. A-диск (наиболее темные участки саркомера) между Z-линиями.
Толстые миозиновые филаменты состоят из нескольких пептидных цепей и включают длинную палочковидную часть («стержень») и двойную шаровидную часть («головку»).
Стержни плотно упакованы в толстом миофиламенте, а головки выступают наружу и при сокращении участвуют во взаимодействии с тонкими миофиламентами благодаря тому, что обладают аденозин-трифосфатазной активностью (содержат АТФазы) и имеют актинсвязывающий сайт.
Тонкие акгиновые филаменты образованы белком, двойная спираль полимерных молекул которого связана с двумя другими белками — тропонином (глобулярный белок) и тропомиозином (фибриллярный белок). Каждая молекула тропомиозина объединена с тропонином, образуя комплекс, который влияет на взаимодействие актина с толстыми миофиламентами, выполняя тем самым важную регуляторную функцию в процессах сокращения и расслабления миокардиоцита.
В состоянии покоя эти белки блокируют активные центры актина, что исключает взаимодействие миофиламентов. В комплексе «тропонин—тропо-миозин» выделяют 3 вида тропонинов: I, С, Т. Тропонин Т (литера Т — от названия «тропомиозин») является связующим звеном между тропомиозином и тропонинами I и С. Тропонин I [литера I — от синонима -Inhibitory subunit (ингибиторная субъединица)] взаимодействует с тропомиозином, чтобы разрешить только слабое связывание между шаровыми головками миозина и актином, а также ингибирует АТФазы миозина. Тропонин С (С от Са2+, гомолог кальмодулина), связанный с Са2+, устраняет ингибирующее влияние тропонина I, что обеспечивает сильное взаимодействие миозина с актином и способствует активации АТФазы миозина.
Микроархитектура мышечного волокна
Миофибриллы — это тонкие волоконца, которые находятся в саркоплазме мышечного волокна кардиомиоцита, располагаясь продольно и параллельно друг другу. Под микроскопом видно, что миофибрилла имеет поперечную исчерченность — чередующиеся темные и светлые полосы. Поперечные полосы [вставочные диски] — это области прикрепления миофибрилл к плазмолемме соседних кардиомиоцитов.
Чередование светлых и темных полос определяется упорядоченным расположением по длине миофибриллы миозиновых [толстых] и актиновых [тонких] нитей: толстые нити содержатся только в темных участках (A-диск), светлые участки [1-диск] не содержат толстых нитей, в середине 1-диска расположена Z-линия [телофрагма]; к ней крепятся тонкие нити актина. Диск А неоднороден: посередине его находится относительно более светлая Н-зона, а в ее центре — М-линия [мезофрагма]; к ней крепятся толстые нити миозина.
Участок миофибриллы, состоящий из A-диска [темной полосы] и двух половинок 1-дисков [светлых полос], называют саркомером. Сокращение длины саркомера происходит путем втягивания тонких нитей актина между толстыми нитями миозина. Сарколемма [клеточная мембрана] имеет Т-трубочки [глубокие инвагинации], которые обеспечивают быстрое распространение деполяризации мембран миофибрилл в условиях их активации. Вокруг миофибрилл располагается густая сеть системы канальцев саркоплазматического ретикулума [депо внутриклеточного кальция].
Процесс сокращения детерминируется цикличностью перекрестного связывания шаровой головки молекулы миозина и миозинсвязывающего сайта на молекуле актина. Повторяющиеся конформационные изменения в молекуле миозина с каждым циклом сшивают сайты тонких нитей с участками толстых нитей. Движение нитей относительно друг друга согласно общепринятой на сегодняшний день модели «скользящих нитей» Хью Хаксли вызывает укорочение саркомера. Гистологической манифестацией этого является сокращение дистанции между Z-линиями.
Механизмы сокращения и расслабления мышечного волокна
Центральную роль в регуляции взаимодействия толстых и тонких нитей играет цитозольная концентрация Са2+. В саркоплазме мышечного волокна, находящегося в состоянии покоя, очень низкая концентрация ионов Са2+. Внутриклеточное перемещение Са2+ между саркоплазматическим ретикулумом (депо кальция) и саркоплазмой обеспечивают две транспортные системы, локализованные в мембранах конечных (терминальных) цистерн (см. рис. 1.3):
Кальциевый насос, который, используя энергию АТФ, способен активно закачивать внутрь цистерн ионы Са2+, поэтому в состоянии покоя вне цистерн, в саркоплазме — очень низкая концентрация ионов Са2+, а внутри цистерн, т. е. в эндоплазматическом ретикулуме, — высокая.
Кальциевые каналы
В покоящемся мышечном волокне они закрыты, а при его возбуждении открываются, что приводит к выходу ионов кальция из саркоплазматического ретикулума и значительному увеличению содержания Са2+ в саркоплазме.
Связывание цитозольного Са2+ с комплексом тропонины—тропомиозин детерминирует более глубокое встраивание тропомиозина в углубления тонких нитей — месторасположение актинсвязывающих сайтов, что обеспечивает возможность сильного взаимодействия актина и миозина. При этом происходит не только прочное кратковременное связывание (стыковка) миози-новых головок с этими сайтами (угол такой стыковки между миозиновыми мостиками и актиновыми нитями составляет примерно 90°), но и увеличение АТФазной активности примерно в 200 раз. Образовавшиеся АДФ и фосфат вытесняет актин из связи с миозиновыми головками, что приводит к их сгибанию. Возникающая при этом напряженная конформация миозиновых головок создает силу, тянущую миофиламенты друг к другу: происходит скольжение (проталкивание) нитей актина относительно нитей миозина до образования угла мостиков примерно в 45°.
Такое перемещение снимает напряженность миозиновых головок, возвращая их в исходное состояние (исходную ориентацию). Головки связывают новые молекулы АТФ, что приводит к размыканию мостиков: АТФ вытесняет актин из комплексов с миозиновыми головками. Затем цикл повторяется с прикрепления головки миозина к новому (последующему) ак-тинсвязывающему сайту, расположенному дальше вдоль актинового фила-мента.
Таким образом, химическая энергия АТФ превращается в механическую энергию сокращения.
Процент тропонинсвязывающих участков, занимаемых Са2+, определяет количество нитей, рекрутированных в процесс сокращения. Отсюда следует, что величина сократительной силы в значительной степени зависит от концентрации цитозольного Са2+.
Циклы замыкания и размыкания мостиков описанного механизма повторяются многократно, отчего тонкие нити все глубже вдвигаются между толстыми миофиламентами: в саркомерах миофибрилл 1-диски и относительно светлая зона A-диска утончаются, а темные части A-диска утолщаются. Общая ширина A-дисков, очевидно, не изменяется: она определяется постоянной длиной толстых миофиламентов. За счет укорочения саркомеров происходит сокращение кардиомиоцитов и мышцы в целом.
Взаимодействие между толстыми и тонкими нитями обусловливает процессы сокращения и расслабления сердечной мышцы.
Регуляция внутриклеточного обмена Са2+
Сокращение кардиомиоцита инициируется деполяризацией мембраны клеток. При деполяризации внеклеточные ионы натрия Na+ и Са2+ поступают в клетки через потенциал-зависимые ионные каналы. Сарколемма кардиомиоцита имеет выраженные углубления (или Т-трубочки), которые обеспечивают быстрое распространение волны деполяризации по всей клетке. Однако количество Са2+, который входит в клетку из внеклеточного пространства, недостаточно для сокращения. Приток внеклеточного Са2+ вызывает высвобождение внутриклеточного Са2+, депонированного в саркоплазматическом ретикулуме. Механизм, с помощью которого небольшое количество Са2+, поступившего из внеклеточного пространства, приводит к высвобождению значительного количества депонированного Са2+, не изучен.
Известно, что Са2+ выходит из саркоплазматического ретикулума через специализированные Са2+-каналы. При этом происходит стократное увеличение внутриклеточной концентрации Са2+ (от 10‘7 до 10’5 моль/л). Са2+ диффундирует по всему саркомеру, связывается с тропонином, обеспечивая сильное связывание миозина с актином и тем самым процесс сокращения.
Расслабление миокардиоцитов (диастола) опосредуется уменьшением внутриклеточной концентрации Са2+. Процесс поступления ионов Са2+ в саркоплазматический ретикулум энергозависим, связан с изменениями активности Са2+-АТФазы и регулируется фосфоламбаном — гидрофобным фосфо-белком, встроенным в стенку саркоплазматического ретикулума.
Фосфорилирование фосфоламбана активирует Са2+-АТФазы, что приводит к увеличению секвестрации Са2+ в саркоплазматическом ретикулуме и, таким образом, способствует релаксации, т. е. развитию диастолы.
В связи с тем что систола и диастола осуществляются при посредничестве цитозольного Са2+, то, регулируя процессы, контролирующие концентрацию внутриклеточного иона Са2+, можно влиять на систолу и диастолу.
В самом деле, например, катехоламины, с одной стороны, действуя через мембранные p-адренергические рецепторы, активируют образование вторичного мессенджера — циклического аденозинмонофосфата (цАМФ), что приводит к фосфорилированию различных белков, в том числе кальциевых каналов, участвующих в мобилизации депонированного Са2+, и соответственно увеличению его цитозольной концентрации, обусловливая развитие систолы, а с другой стороны, фосфорилирование фосфоламбана способствует не только увеличению секвестрации Са2+ в саркоплазматическом ретикулуме, но и, таким образом, — релаксации миофибрилл, т.е. развитию диастолы. Таким образом, активация (3-адренергических рецепторов может усиливать как систолу, так и диастолу.
В заключение перечислим основные виды транспорта кальция в рабочих кардиомиоцитах.
1. Вход кальция в цитоплазму из наружной среды через медленные кальциевые каналы сарколеммы.
2. Активное выведение кальция из кардиомиоцитов с помощью Са2+-АТФазы сарколеммы.
3. Активное выведение кальция из кардиомиоцитов с помощью натрий-кальциевого обменника сарколеммы.
4. Кальцийиндуцированное высвобождение кальция в цитоплазму из саркоплазматического ретикулума обеспечивают кальциевые каналы рианодинового типа.
5. Активное закачивание кальция в саркоплазматический ретикулум с помощью его Са2+-АТФазы.



